热力学仅从能量观念出发,研究热力学系统状态变化中热功转换(两种过程能量)的关系与条件。
热力学定律的意义
- 第零定律:热平衡定律,定义了温度的概念。
- 第一定律:包括热现象在内的能量守恒与转化(转化的思想容易被忽视)定律,指明了热力学过程中热功转化之间的数量关系。
- 第二定律:熵增定律,指明了热力学过程进行的方向与条件。
- 第三定律:指明绝对零度不可到达。
一、热力学第一定律
1.1 定律内容
热力学第一定律写作:
这里需要有以下几点解释:第一,Q如果是正的,那么就是系统吸热,反之,则是系统放热。第二、做功A如果是正的,那么是系统对外做功,反之,则是系统被做功,与Q是相反的,之所以写成这样,是因为这是一个由1到2的过程。第三,只有E是一个状态函数($Q,\Delta E$ 都是与过程息息相关),他是一个状态函数的原因是他是温度的单值函数,而温度是一个状态量,有以下关系:
但是需要注意的时,在这一节中,还有一个公式写成
上面两个式子其实是一个式子,因为有 $C_{V,,m} = \frac{i}{2}R$ 。正因为如此,下面这个本来由等体过程推导出来的式子,可以用来计算任何过程的 $\Delta E$ 。这本质是因为这是一个状态函数,才有了这种神奇的性质。
1.2 公式计算
在热力学第一定律的公式中,可以看出 $\Delta E$ 的计算相对固定(也就是利用温度进行计算),而Q是没有其他公式可以与之关联的,所以要计算Q,就要算 $\Delta E$ 和做功A,那么A又是积分,所以总的来说,就是在处理A的积分,同时,A的积分还对应了p-v图的面积,正负由起始与终止描述。对于A的描述,我们一般会获得一个过程方程,这个过程方程在p-v图上对应一条线,气体状态就沿这条线变化,这个方程一般作为解题的重要条件。
我们在具体处理的时候,因为有理想气体状态方程,所以我们经常进行换元积分。
1.3 热功转换
我平时很喜欢从右往左看这个公式,就是说将内能和功视为因,吸放热视为果,这其实是不对的,这个公式写成这个样子(我说的其他样子是通过移项得到的),是因为它描述的是热机。左侧是因,右侧是果。
热机的意思是将热量转化成功的机器。热机吸收热量,但是却不能完全转化为对外作功,这是因为有一部分热量被用来使热机自身的温度升高了,这就是这个公式的意思,它指出了吸收的热量的两个去处。用这个角度理解,就可以明确的知道正负的含义了。
在系统状态变化的过程中,功与热的转化不可能是直接的,而是通过物质系统来完成的。向系统传递热量可使系统的内能增加,再由系统内能减少对外做功;或者外界对系统做功,使系统内能增加,再由内能减少,系统对外界传递能量。
所谓的第一类永动机说的就是如果 $Q = 0$ 的情况下,依然可以对外做功,这显然是不可能的。
二、准静态过程
2.1 等体过程
等体过程的意思就是吸收的热量全部转化为内能,而不对外做功,有
其中 $C_{V,m}$ 是定容热容,角标的 $V$ 表示是等体过程,而 $m$ 表示是 1 $molor$ .
2.2 等压过程
等压过程的意思是吸收的热量不仅转化为热能,而且还有一部分转化为对外做功,不仅转化为对外做功,而且还是以等压的形式对外做功。这就表示做功的积分求法很容易。
有迈耶公式
再引入绝热系数的概念:
2.3 等温过程
有做功
这里回顾一下,对于一个指定气体的状态,有三个状态变量,只要知道了其中的两个,确定整个状态。
这其实就是个双曲线积分,过程函数与状态曲线重合了。
2.4 绝热过程
有重要过程方程
这个公式不太好推导,所以最好记住,这是一条比等温线更加陡峭的曲线。关于这个结论,有如下推导。首先推导等温线的斜率,有
然后推导绝热线的斜率
可以看出,绝热线的斜率更大。
当我们有了这个式子以后,在结合理想气体状态方程,可以推导出其他的等式
上下两式直接做比,就可以得到
其他等式推导类似。
2.5 多方过程
介绍多方过程主要是为了引出一个重要的二级结论:“绝热线是区分吸放热的界限,在足够短的一段过程中,在绝热线以下的简单过程(即没有圆之类的)是放热的,在绝热线以上的简单过程是吸热的。(图里写反了)”。如果用图像表示,即
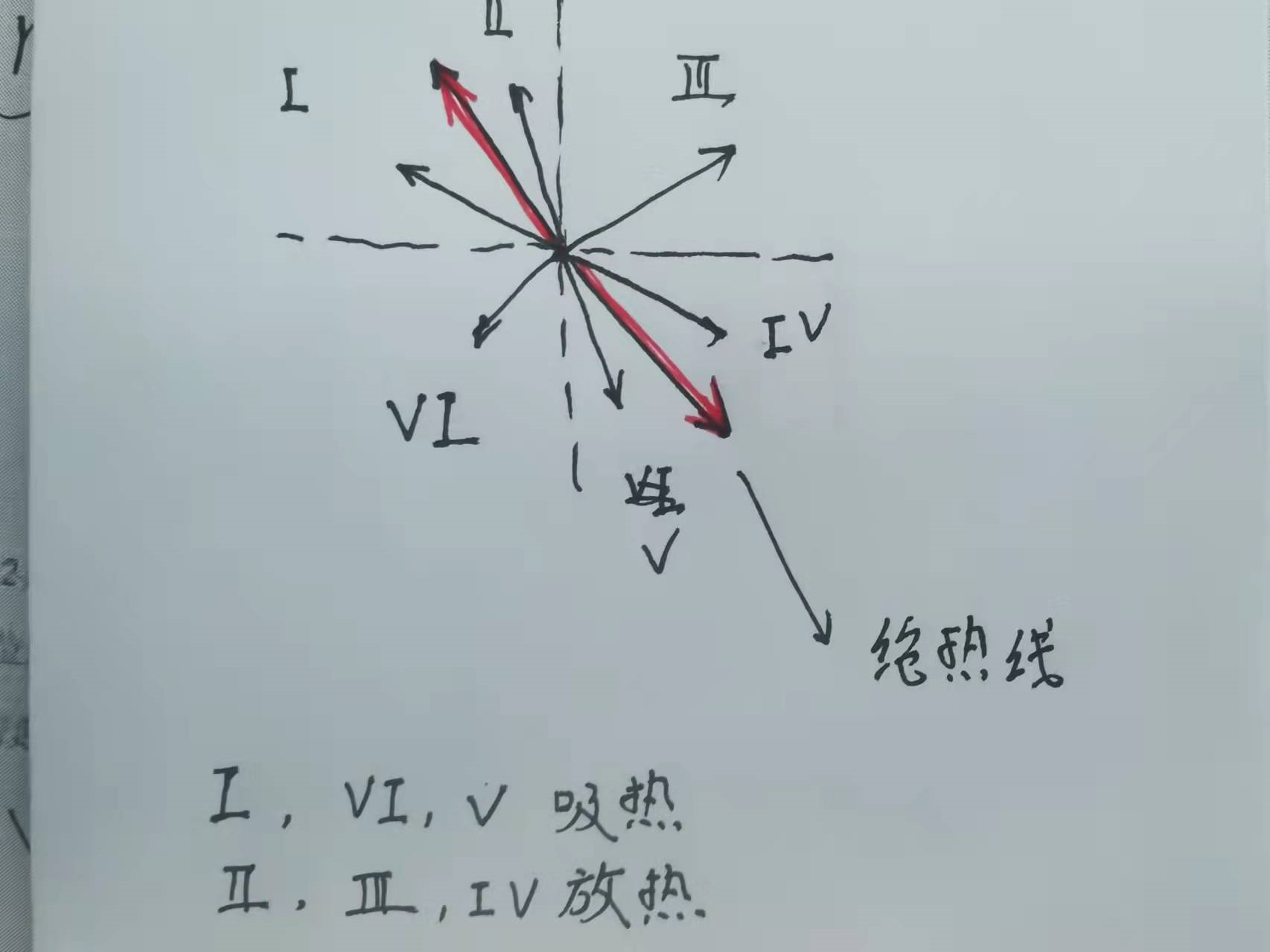
关于这个定理的证明,需要用到多方过程的结论。
多方过程描述的是一小段足够短的过程,他可以用方程来描述
其在 $(p,V)$ 处的斜率是 $n\frac{p}{V}$。
其中 $n$ 被称为多方指数,然后我们有它的摩尔热容是(已知定理)
显然,如果这个值是个正数,那么就是吸热,反之,则是放热,讨论 $V$ 区域,可以看到 $V$ 区域的斜率要大于绝热线,所以有 $n>\frac{i+2}{i}$ ,那么可以知道
升高温度需要吸热,而 $V$ 区域变化是像下降温度去的,所以是放热。
三、循环过程
3.1 循化过程
一个热力学系统从某一个状态出发,经过一系列变化过程,最后又回到了初始状态。这样的一个过程称为循环过程。
系统沿闭合曲线顺时针方向的循化称为正循环,做正循环的设备叫做热机,它从高温热源吸收热量,对外做功并且对低温热源放热。系统沿闭合曲线逆时针方向的循环称为逆循环,做逆循环的设备叫做制冷机,他从低温热源吸收热量,外界对其做功,最终对高温热源放热。
循环过程的一个特征是系统经历一个循环后内能不变,也就是说,系统吸收的净热量等于系统对外所做的净功。有
3.2 热机与制冷机
对于热机来说,要从高温热源吸收热量,这个热量会转化为向低温热源传递的热量和对外做的功。所以有等式
那么热机效率应该看的是热能比值,即
对于制冷剂而言,要对制冷剂做功,使其能够从低温热源吸收热量 $Q_2$ ,并将热量传导给高温热源 $Q_1$ ,所以有等式
对于效率,人们一点也不关心垃圾桶(在热机中是低温热源,制冷机是高温热源)。人们只关心自己的投入和产出,所有的效率都是产出比投入。对于制冷系数,有
3.3 卡诺循环
卡诺循环是一种具有最高效率的理想循环。他的循环如图
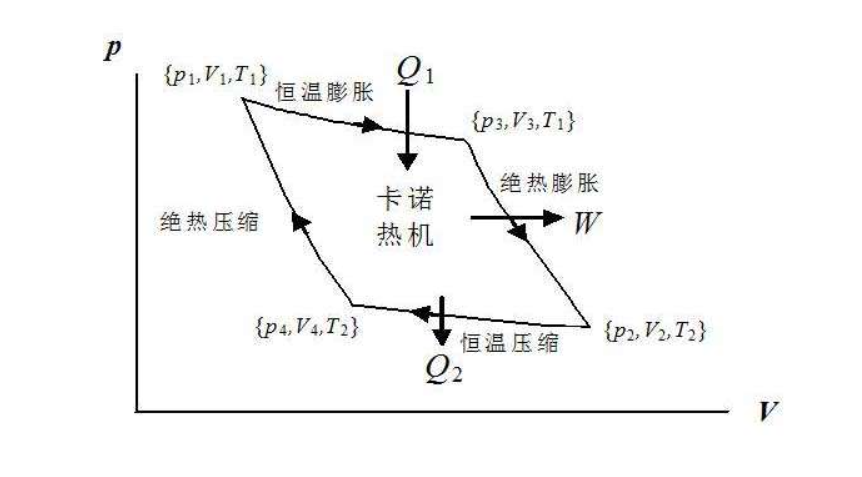
我们先来直观的感受一下他为啥是最高效的,我将热机分为两个功能,一个是工作:在高温热源处的吸热膨胀或者在低温热源处的放热收缩,这是热机的本职工作,另一个是衔接:也就是说,热质在工作的时候会有一个温度的变化,那么就需要一个过程来完成从高温到低温,再由一个过程完成由低温到高温。
对于工作的过程,肯定是等温过程最好,这是因为只有等温过程吸收的热量全部转换为了功,而不会使内能增加。对于衔接过程,肯定是绝热过程最好,因为绝热过程保证了热量不会逸散,也就是说,由于温度下降导致的内能减少,全部用作了对外做功。以奥托循环(现实热机循环)做比
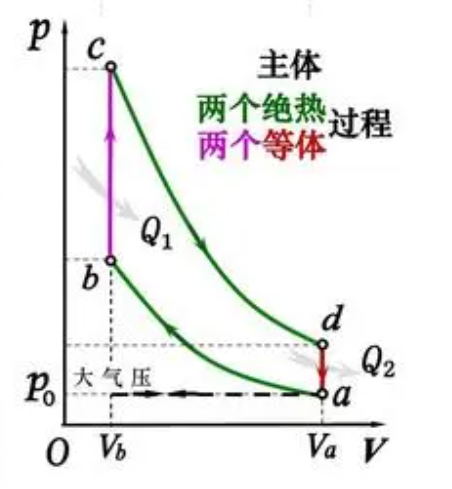
因为用的是等压过程,所以一部分的内能转换为热能,就有所损失。
在卡诺循环中,经过复杂的推导(所以就不列了)有恒等关系
这其实也是可逆过程的熵恒等。
四、热力学第二定律
4.1 热力学第二定律
一切与热现象有关的实际宏观过程都是不可逆的。
有一个有意思的表述:两条绝热线不能相交。因为这样就可以让两条绝热线,一条等温线构成一个循环,这样热机的效率就是 100% 了。
4.2 卡诺定理
- 在同样的高低温热源之间工作的一切可逆机,其效率都是 $1 - \frac{T_2}{T_2}$。
- 在同样的高低温热源之间工作的一切不可逆机,效率不可能高于可逆机。
4.3 可逆过程与熵
设存在一个过程,使物体从状态 A 变为状态 B,对它来说,如果存在另一个过程,它不仅使物体反向变化,从状态 B 变为状态 A,而且当物体回到状态 A 的时候,周围的一切各自恢复到原状,则从状态 A 进行到状态 B 的过程是一个可逆过程。
需要注意的是,可逆只是过程的一种性质,可逆过程不需要一定是一个循环过程。
只有非常缓慢的亦即准静态的膨胀/压缩过程,才是可逆的膨胀/压缩过程。所有的宏观热现象都是不可逆的。
对于熵,我们有这样的一种算法
其中 $\delta Q$ 是在各无限短的过程中吸收的微小热量。有趣的是,尽管熵是一个状态量,但是其计算依赖于这个过程一定要是一个可逆过程。否则这个公式就不能应用。比如我们在计算气体自由膨胀的时候,这个式子就不能用了,需要我们将这个过程转换为一个等温膨胀才能够使用。
所以我们又提出了玻尔兹曼关系作为补充,有
其中 $W$ 是系统所包含的微观状态数,被称为热力学概率。